12024届遂宁市高第二次诊断性考试化学试卷答案试卷答案,我们目前收集并整理关于12024届遂宁市高第二次诊断性考试化学试卷答案得系列试题及其答案,更多试题答案请关注本网站

12024届遂宁市高第二次诊断性考试化学试卷答案试卷答案
以下是该试卷的部分内容或者是答案亦或者啥也没有
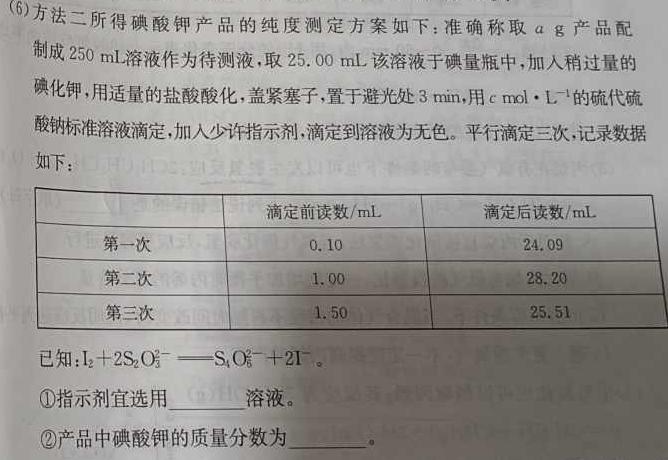
(6)方法二所得碘酸钾产品的纯度测定方案如下:准确称取ag产品配制成250mL溶液作为待测液,取2500m该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化,盖紧塞子,置于避光处3min,用cmol·L的硫代硫3cmolL^-1酸钠标准溶液滴定,加入少许指示剂,滴定到溶液为无色。平行滴定三次,记录数据如下:已知::I2+2S2O3^2-S4O6^2-+2I^-。①指示剂宜选用溶液。②产品中碘酸钾的质量分数为。
(3)已知破坏1molH-H键、1mol0=0键、1molH-O键时分别需要吸收436kJ、498kJ、465kJ的能量。下图表示H2、O2转化为水反应过程的能量变化,则b表示的能量为。反应过程若该氢氧燃料电池的电解质溶液为碱性溶液,电池总反应为2H2+O22H2O。,该电池的正极反应式为。当转移2mol电子时,理论上有水生成。

A.活化能:反应I<反应ⅡB.t1时,反应I此时已经处于平衡状态C.t1时刻测得CO、CO2的浓度分别为为0.70molL^-1、0.16molL^-1,,反应Ⅱ达平衡时,测得H2的浓度为ymolL^-1。,则反应Ⅱ的平衡常数为K2=6y^21.0-yyD.相同条件下,若反应起始时溶液中同时还含有0.10molL^-1盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是b

14.AgNO3标准溶液的pH近似为5,用AgNO3溶液滴定NaX溶液的反应为NaXAgX+NaNO3(X为Cl、Br)。常温下,用.100AgNO3+0.1000molL^-1AgNO3溶液分别滴定20.00mL0.1000molL^-1的NaCl溶液、NaBr溶液,混合溶液的1c(Ag^+)与Ag3溶液体积的变化关系如图所示。已知:常温下,Knp(AgCl)=1.8×1010,K(1.810^-10,K(AB)r)=5.410^-13,Br)=5.4×10,当溶液中离子浓度110^-5molL^-1时,该离子沉淀完全。下列说法错误的是A.a为AgNO3标准溶液滴定NaBr溶液的滴定曲线B.当滴人AgNO3标准溶液的体积为20mL时,NaX溶液中::c(Ag^+)+c(H^+)=c(X^-)+c(OH^-)C.相同实验条件下,若改用10.00mL0.2000molL^-1NaCl溶液,则滴定曲线(滴定终点前)可能变为MD.若用0.1000molL^-1的标准AgNO3溶液滴定20.00mL0.0100molL^-1NaCl、NaBr浓度均为混合液,当Br^-沉淀完全时,已经有部分Cl^-沉淀

(5)由题目信息可知,向“溶液2”中加人的物质A为2^5正极电极反应式为。(6)某锂电池放电过程中,电极上发生Li,(MoS)与MoS,之间的转化,则电池放电时Lix(MoS2)n